推荐产品

NovoScript® Plus All-in-one 1st Strand cDNA Synthesis SuperMix (gDNA Purge)
品牌:近岸蛋白(Novoprotein)
询价
询价公司新闻/正文
GLP1R/GIPR/GCGR/FGF-21—降糖减重明星靶点,未来可期!
人阅读 发布时间:2023-09-22 15:46
糖尿病被认为是增长最快的全球健康问题,据国际糖尿病联合会估计,到2045年,全球糖尿病人口将达到7.83亿人。糖尿病都有一个共同的临床表现:高血糖,以及一些特征性症状,包括口渴、多尿、持续饥饿、疲劳、体重减轻和视力模糊。随着病情的发展,可能出现视网膜病变、肾病、神经病变等并发症,发生心血管疾病、肥胖、非酒精性脂肪性肝病的风险增加,显著影响生活质量。在糖尿病病例中2型糖尿病(T2DM)占90%以上。
胰腺β细胞功能障碍导致的胰岛素缺乏是T2DM的主要特征,然而,大多数药物并不针对β细胞,并且随着糖尿病的进展而变得不那么有效。幸运的是,几种肠道来源的天然肽,称为肠促胰岛素,可以刺激胰岛素分泌,启发了新的T2DM治疗方法。肠促胰岛素包括胰高血糖素样肽-1 (GLP-1)和葡萄糖依赖性胰岛素性多肽(GIP)。虽然在健康状态下GLP-1和GIP都能促进胰岛素分泌,但单独使用GIP的治疗潜力存在争议。相比之下,GLP-1受体(GLP1R)被认为是葡萄糖依赖型T2DM治疗中最重要的潜在药物靶点之一,与胰岛素和磺脲类药物相比,GLP1R可降低低血糖风险[1]。
GLP1R简介
G蛋白偶联受体(GPCRs)广泛分布于多种组织中,在多种生理活动中发挥关键作用。作为最大的受体家族,GPCRs是广泛适应症的重要药物靶点。GPCRs共享一个保守的七跨膜螺旋束,有三个细胞外环(ECLs)和三个细胞内环(ICLs)。ECLs形成与正构配体相互作用的细胞外表面,而ICLs在很大程度上决定下游受体信号传导[1]。 GLP-1作为GLP1R的内源性激动剂,具有厌氧、促胰岛素和减肥作用,是一种很有前景的天然降糖产品。然而,在体内,二肽基肽酶4 (DPP-4)在其N端分泌第二氨基酸(丙氨酸)后可立即将GLP-1切割,这将导致GLP-1立即降解,在人体内循环时间短。尽管GLP-1具有许多潜在的优势,但其循环时间约为2分钟,频繁给药与患者的依从性不相容,从而降低了药物的有效性,限制了其在治疗中的应用。延长循环时间的DPP-4抑制剂和GLP-1类似物已应用于肠促胰岛素治疗并取得良好效果。然而,GLP1R激动剂由于具有更好的体重控制和心血管预后效果备受青睐[1]。
为了阐明GLP1R信号转导的机制,研究人员多年来一直在进行GLP1R的功能研究。GLP1R下游信号通路网络可通过与胞内换能器偶联而激活。不同的蛋白质结合形式将导致复杂的下游途径。目前认为GLP1R主要通过Gαs/cAMP通路发出信号;然而,有证据表明GLP1R与Gαq和其他G蛋白偶联。激活后,GLP1R在C端发生磷酸化,进一步募集β-arrestin,导致受体内化和脱敏。Gαs/cAMP途径直接导致葡萄糖诱导的胰岛素颗粒分泌。在被GLP-1等完全激动剂激活后,GLP1R与Gαs偶联,激活腺苷酸环化酶(AC),引起cAMP的积累。随着cAMP水平的升高,蛋白激酶A (PKA)和由cAMP-2(Epac-2)直接激活的交换蛋白也被激活。PKA和Epac-2触发KATP和KV通道的关闭,从而使细胞膜去极化,打开电压依赖性钙通道(VDCC),并引起Ca2+内流。除了cAMP的经典功能外,cAMP/CREB通路还能诱导胰岛素受体底物2 (insulin receptor substrate 2, IRS2)的表达,促进β-细胞存活,证明GLP-1类似物对β-细胞的保护作用[1]。
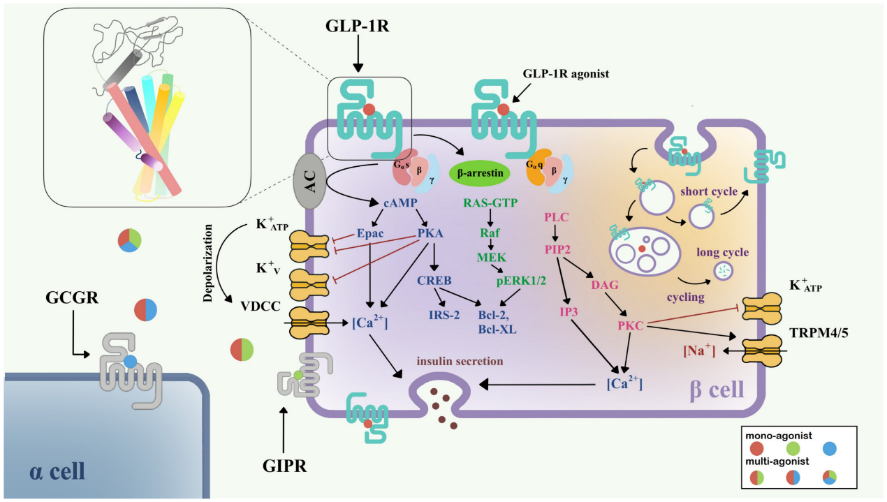
图1. GLP1R在胰岛β细胞中的信号通路[1]
胰高血糖素样肽-1受体(GLP1R)是2型糖尿病(T2DM)的关键治疗靶点。许多靶向GLP1R的药物已经进入临床治疗。然而,对副作用小、疗效高的新型功能分子的需求仍然很大。
GIPR简介
GIPR(Gastric inhibitory polypeptide receptor,胃抑制肽受体)是GIP的受体,是具有7个跨膜域的G蛋白偶联受体。GIP通过与GIPR的作用,来调节机体的能量代谢,特别是肠促胰素效应。研究表明GIPR在调控胰岛素分泌、血糖和脂代谢方面扮演着重要的角色,对维持正常的代谢状态至关重要。 目前GLP-1受体激动剂(GLP1RA)类药物目前已被确定为不仅治疗T2D而且治疗肥胖的药理学疗法,并且可能对患有心肾功能障碍的T2D患者有进一步的益处。然而,尽管GLP-1疗法具有令人信服的特性,许多患者仍然没有达到他们的血糖和体重下降目标。肥胖和T2D的结合,推动了对能够补充和增强GLP1R激动作用的药物的需求。预计下一代T2D药物将被设计为通过单分子药物的新型制药工程来参与互补机制。其中一个策略是集中在产生单肽激动剂,以利用GLP1R活性,同时也靶向葡萄糖依赖性胰岛素性多肽受体(GIPR)。这种新方法的目的是进一步增加代谢益处,同时尽量减少不良事件。重要的是,这种方法已经增强了T2DM患者的血糖控制和体重减轻,突出了GIPR信号轴作为一个有希望和有效的共同靶点。因此,双重激动剂激发了人们对了解GIPR参与如何有助于增强代谢控制的新兴趣,特别关注对减肥的明显有益影响[2]。 Lu等人的研究表明,用双特异性分子对抗/激活GIPR/GLP1R通路可以降低肥胖小鼠和猴子的体重和代谢参数。机制研究表明,这些分子同时与GIPR和GLP1R结合并触发受体内化,在表达这两种受体的细胞中放大cAMP信号[3]。
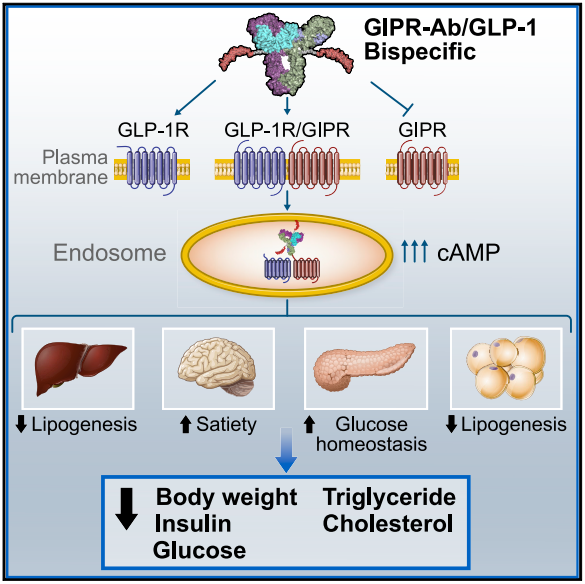
图2. 双特异性分子对抗/激活GIPR/GLP1R通路[3]
GCGR简介
胰高血糖素是一种线性肽,含有29个氨基酸。它由胰岛细胞分泌,主要作用于肝细胞。GCGR是一种主要存在于胰岛β细胞和肝细胞中的G蛋白偶联受体(GPCR)。激活GCGR和GLP1R促进胰岛β细胞胰岛素分泌。胰高血糖素与β细胞上的GCGR和GLP1R结合,激活的受体与G蛋白Gαs结合。这导致腺苷酸环化酶激活和cAMP形成。葡萄糖与GLUT2结合,增加ATP水平和细胞内钙浓度,增强胰岛素胞外分泌。细胞内cAMP水平的增加激活PKA,这也促进胰岛素胞外分泌[4]。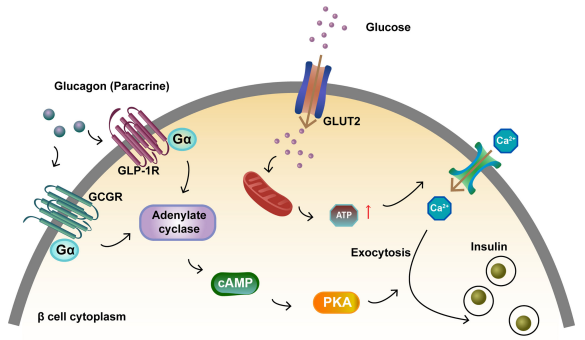
图3. 激活GCGR和GLP1R促进胰岛β细胞胰岛素分泌[4]
目前GCGR拮抗剂已被提议作为治疗T1D或T2D的药理学方法,包括使用小分子拮抗剂、针对GCGR的单克隆抗体(mAb)和降低受体表达的反义寡核苷酸。相关临床试验表明,它们可以通过抑制胰高血糖素的作用来降低血糖水平。REMD 477是抗GCGR的完全竞争性单抗。单剂量REMD-477可显著降低T1D患者的胰岛素需求,改善患者的血糖控制,无严重不良反应。另一种GCGR单克隆抗体REGN1193具有良好的安全性和耐受性,但也观察到转氨酶短暂升高。综上所述,GCGR单克隆抗体有望改善血糖控制,具有很大的研究前景[4]。
FGF-19/21简介
2005年,Kharitonenkov等人在一项基于细胞的高通量筛选研究中首次发现FGF21的代谢活性具有降低血糖的积极作用,因为它能够诱导脂肪细胞摄取葡萄糖[5]。虽然肝脏是循环FGF21的主要来源,但FGF21的表达也可在其他几个代谢器官中检测到,包括脂肪组织、胰岛和骨骼肌[6-7]。2018年,上海交通大学附属第六人民医院内分泌代谢科贾伟平教授课题组在《自然》子刊《自然通讯》上发表题为“Fibroblast growth factor 21 increases insulinsensitivity through specific expansion of subcutaneous fat”的研究成果。该研究发现,在能量摄入过剩时,肝脏分泌的激素样因子成纤维细胞生长因子21(FGF21)能通过促进皮下脂肪的增生和调控其功能,从而维持胰岛素敏感性和糖代谢稳态[8]。
成纤维细胞生长因子(FGF)家族蛋白在细胞增殖、分化、发育和代谢等方面发挥着多种作用。其中,两个经典成员(FGF1和FGF4)和两个内分泌成员(FGF19和FGF21)是全身能量稳态、糖/脂代谢和胰岛素敏感性的重要调节因子。临床前研究一致证明了这些FGFs在治疗肥胖、糖尿病、血脂异常和非酒精性脂肪性肝炎(NASH)方面的治疗益处。一些基因工程的FGF19和FGF21类似物具有改善的药效学和药代动力学特性,并已开发并进入临床试验的各个阶段[9]。
目前抗体药物开发进展情况
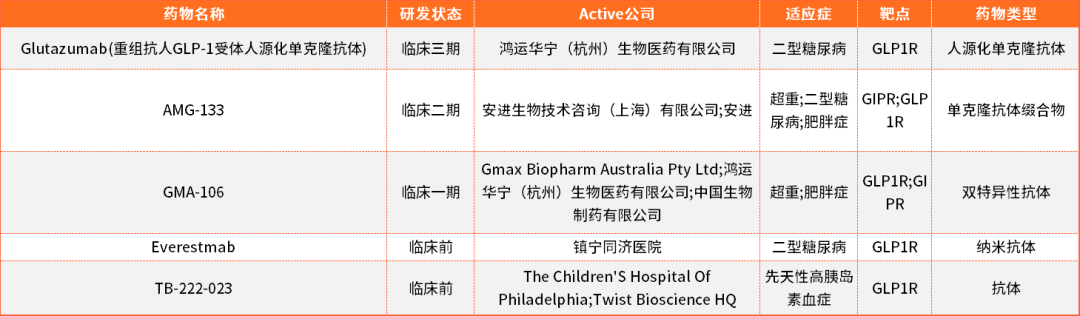
降糖减重药物主要还是基于GLP1R靶点进行研究的,目前全球已经有多款上市的化药和重组多肽类药物,单抗和双抗等药物研发处于临床或者临床前阶段,暂未有上市药物。
表1.目前部分抗体药物开发进展情况表(来源于药渡数据库)
近岸蛋白提供GLP1R/GIPR/GCGR/FGF-21等多种降糖减重热门靶点,适用于机制研究和靶向药物开发。
部分产品数据展示:
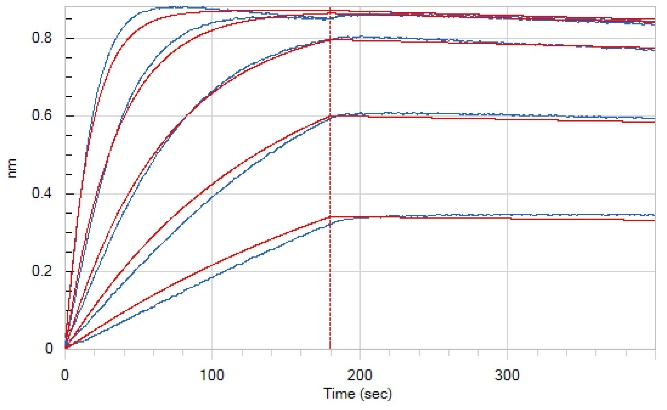
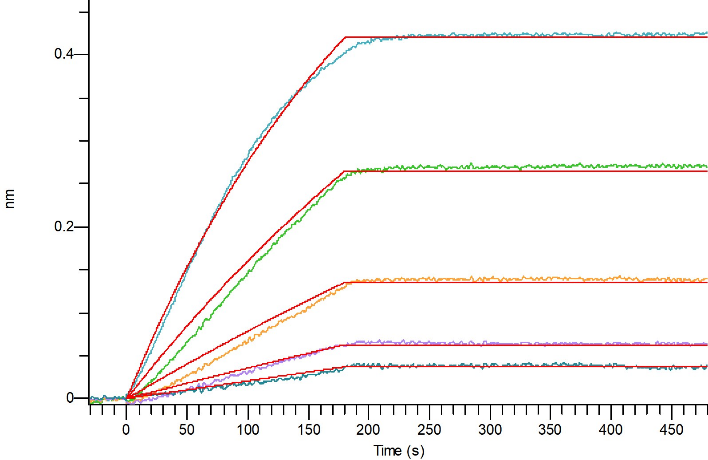
Loaded Anti-Human GIPR Antibody(L7H6) on Pro-A Biosensor, can bind Recombinant Human GIPR N-ECD (C-6His) (Cat#C28P) with an affinity constant of 0.532 nM as determined in BLI assay.
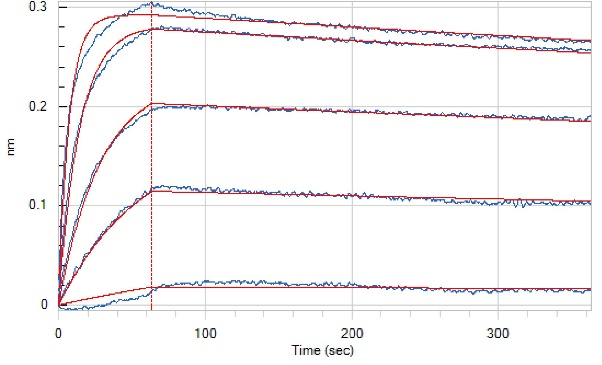
Loaded Anti-Human GIPR Antibody(L7H6) (Bio-tag) on SA Biosensor, can bind Recombinant Human GIPR N-ECD (C-Fc) (Cat#C28R) with an affinity constant of 1.12 nM as determined in BLI assay.
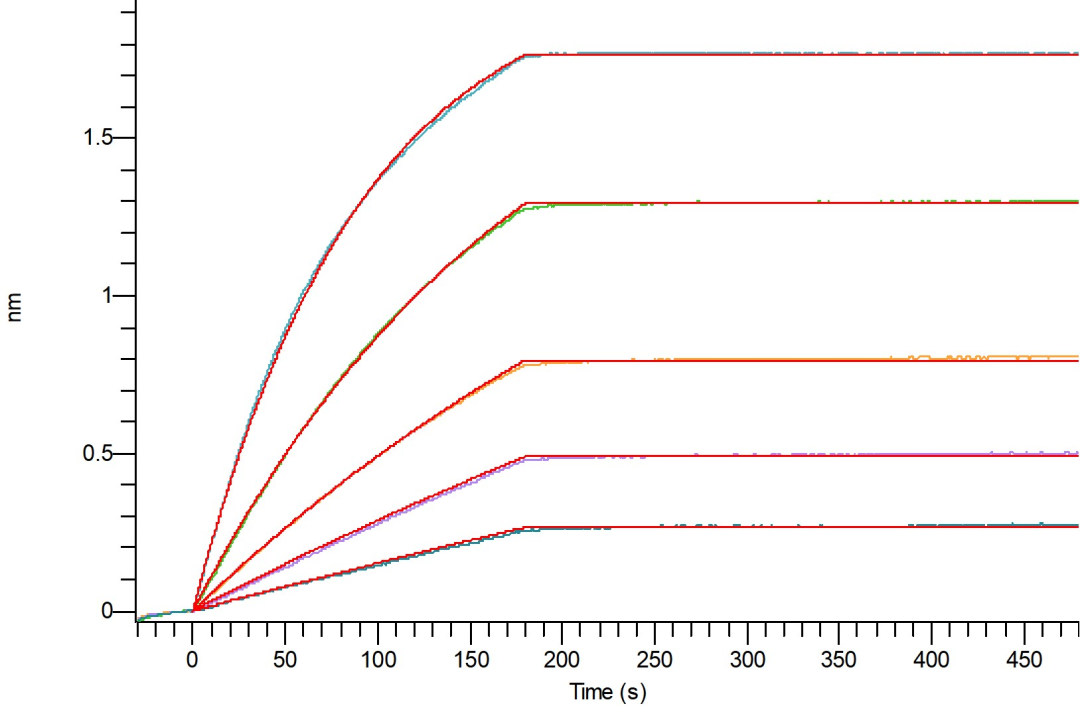
Loaded Biotinylated Human GIPR(C-6His-Avi) on HIS1K Biosensor, can bind Anti-Human GIPR Antibody(Human IgG1) with an affinity constant of 2.05 pM as determined in BLI assay.
相关产品推荐:
| Cat. No. |
Product Name |
| CU74 |
Recombinant Human GLP1R(Arg24-Tyr145)(C-Fc) |
| C29P |
Recombinant Human GLP1R N-ECD (C-6His)* |
| C29R |
Recombinant Human GLP1R N-ECD (C-Fc) * |
| C29S |
Recombinant Cynomolgus GLP1R N-ECD (C-6His) * |
| C28P |
Recombinant Human GIPR N-ECD (C-6His) |
| C28R |
Recombinant Human GIPR N-ECD (C-Fc) |
| CY126 |
Biotinylated Human GIPR N-ECD (C-6His-Avi)* |
| C29F |
Recombinant Mouse GIPR N-ECD (C-Fc)* |
| C29G |
Recombinant Mouse GIPR N-ECD (C-Fc)* |
| C29H |
Recombinant Cynomolgus GIPR N-ECD (C-Fc)* |
| C29K |
Recombinant Human GCGR N-ECD (C-6His)* |
| C29M |
Recombinant Human GCGR N-ECD (C-Fc) * |
| CG74 |
Recombinant Human FGF-19 (N-6His) |
| C223 |
Recombinant Human FGF-21 (N-6His) |
| NC119 |
Recombinant Human FGF-21 (N-6His) |
| C04D |
Recombinant Mouse FGF-21 (C-6His) |
| CS24 |
Recombinant Cynomolgus FGF-21 (C-6His) |
参考文献:
[1] Wan W, Qin Q, Xie L, Zhang H, Wu F, Stevens RC, Liu Y. GLP-1R Signaling and Functional Molecules in Incretin Therapy. Molecules. 2023 Jan 11;28(2):751.
[2] Samms, Ricardo J et al. “GIPR Function in the Central Nervous System: Implications and Novel Perspectives for GIP-Based Therapies in Treating Metabolic Disorders.” Diabetes vol. 70,9 (2021): 1938-1944.
[3] Lu, Shu-Chen et al. “GIPR antagonist antibodies conjugated to GLP-1 peptide are bispecific molecules that decrease weight in obese mice and monkeys.” Cell reports. Medicine vol. 2,5 100263. 30 Apr. 2021.
[4] Jia Y, Liu Y, Feng L, Sun S, Sun G. Role of Glucagon and Its Receptor in the Pathogenesis of Diabetes. Front Endocrinol (Lausanne). 2022 Jun 16;13:928016.
[5] Kharitonenkov A, Shiyanova TL, Koester A, Ford AM, Micanovic R, Galbreath EJ, Sandusky GE, Hammond LJ, Moyers JS, Owens RA, Gromada J, Brozinick JT, Hawkins ED, Wroblewski VJ, Li DS, Mehrbod F, Jaskunas SR, Shanafelt AB. FGF-21 as a novel metabolic regulator. J Clin Invest. 2005 Jun;115(6):1627-35.
[6] Geng L, Lam KSL, Xu A. The therapeutic potential of FGF21 in metabolic diseases: from bench to clinic. Nat Rev Endocrinol. 2020 Nov;16(11):654-667.
[7] Wente W, Efanov AM, Brenner M, Kharitonenkov A, Köster A, Sandusky GE, Sewing S, Treinies I, Zitzer H, Gromada J. Fibroblast growth factor-21 improves pancreatic beta-cell function and survival by activation of extracellular signal-regulated kinase 1/2 and Akt signaling pathways. Diabetes. 2006 Sep;55(9):2470-8.
[8] Li, Huating , et al. "Fibroblast growth factor 21 increases insulin sensitivity through specific expansion of subcutaneous fat." Nature Communications 9.1(2018):272.
[9] Jin L, Yang R, Geng L, Xu A. Fibroblast Growth Factor-Based Pharmacotherapies for the Treatment of Obesity-Related Metabolic Complications. Annu Rev Pharmacol Toxicol. 2023 Jan 20;63:359-382.